研究内容
がんは、その起源となる細胞が、生存に有利な遺伝子変異(=ドライバー変異)を獲得し、そこから、新たな変異の獲得とクローン選択をうけて、遺伝学的に多様な細胞集団へと進化することにより引き起こされる疾患です。
近年、次世代シーケンス技術(next-generation sequencing: NGS)を用いた大規模かつ系統的ながんゲノムの解析が行われ、様々ながんにおける遺伝子変異に関する知見は急速に拡大してきました。具体的には、遺伝子変異、コピー数異常、構造異常、融合遺伝子などの様々な種類の体細胞異常が明らかにされ、さらには、非コード領域やエピジェネティクスの異常についての知見も蓄積され、がんの発症・進展に重要であるドライバー遺伝子異常の全体像が明らかにされつつあります。
一方で、新たに見出された遺伝子異常の生物学的な役割については、解明すべき疑問が数多く残されています。また、遺伝子異常を獲得した細胞が、周囲の細胞との相互作用や、加齢や慢性炎症をはじめとした様々な影響をうけて、がんとしての特性を獲得するにいたる分子メカニズムについても多くが不明です。
当研究室では、とくに血液のがんに焦点をあて、患者検体や病態を模倣するマウスモデルを用いて、オミクス解析(ゲノムシーケンス、RNAシーケンス、エピジェネティクス解析、シングルセル解析など)によるデータサイエンスと、遺伝子編集技術などの最新の分子生物学的手法をとりいれて、がんの未知の病態を解き明かすことを主な研究テーマとしています。
基礎研究を通じて発見した、がんの病態についての新しい知を、臨床に還元する橋渡し研究につなげ、病気の克服および人々の健康の増進に貢献することを目指しています。
1. 造血器腫瘍のがんゲノム解析
難治性の造血器腫瘍である骨髄異形成症候群(MDS)は、血球形態の異常を伴った骨髄不全と急性骨髄性白血病(AML)への移行を特徴とする、高齢者に好発する難治性の慢性骨髄性腫瘍です。
私たちは、骨髄系腫瘍を対象として、次世代シーケンス技術を用いた全エキソン解析などの遺伝子変異の包括的な探索を通じて、コヒーシン複合体の主要な構成要素STAG2, RAD21, SMC1A, SMC3のパスウェイ変異および欠失が、AMLやMDSの約10%に互いに排他的に頻発することを報告しました。コヒーシン複合体は、細胞分裂において姉妹染色体の正確な分配を保証する役割を果たしており、他の固形腫瘍では、コヒーシン複合体遺伝子の変異により染色体の異数性が惹起され、がん化の原因となると言われていました。しかし、骨髄系腫瘍では、コヒーシン変異により染色体の異数性は変化せず、コヒーシン複合体の染色体への結合能が低下することを介して発現異常をきたすことを明らかにしました(Kon et al., Nat Genet. 2013)。
このほかにも、MDSの最も高頻度に変異を認めるスプライシング因子(Yoshida et al., Nature 2011)や、SETBP1 (Makishima et al., Nat Genet. 2013, Sakaguchi et al., Nat Genet. 2013) などの新たなドライバー遺伝子変異を同定しました。さらに、多数の症例を対象にした網羅的遺伝子変異解析により、遺伝子変異情報を含めた予後予測モデルの作成や、遺伝子変異間の協調・排他関係が明らかになりました。現在では、既知のドライバー遺伝子に関して患者の腫瘍検体のシーケンス解析を行い、診断、予後予測、治療法の選択に役立てるクリニカルシーケンスが日常臨床で行われ、ゲノム情報に基づいた治療方針の決定(precision medicine)に応用されています。

2. 造血器腫瘍の遺伝子異常の分子病態解析
大規模ゲノムシーケンス解析を通じて新規に発見された遺伝子変異が、どのようにして造血幹/前駆細胞クローンの選択と進化をもたらし、造血器腫瘍を発症するのかを解明することは、新たな機序による病態の理解とそれに基づく新規治療標的の同定のためにも重要です。そのため、骨髄系腫瘍の新規遺伝子変異のマウスモデルの解析を中心として、病態解明を精力的におこなっています。
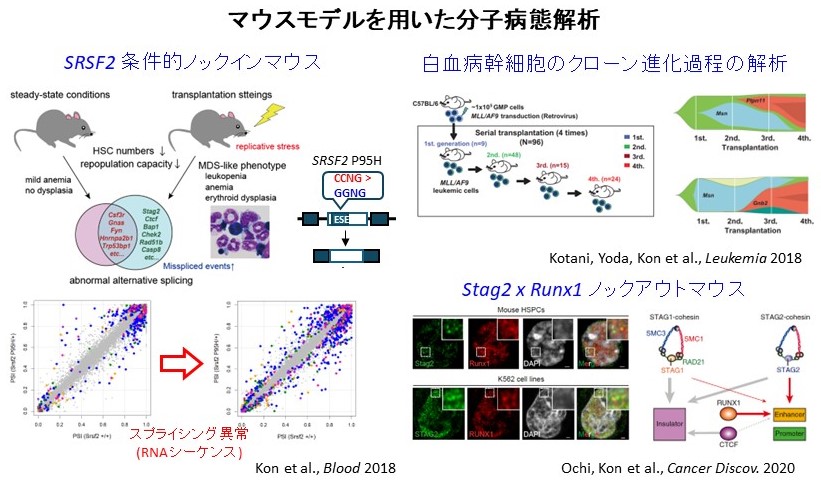
MDSで最も高頻度にみられるスプライシング因子の主要な機能獲得型変異Srsf2 変異に関する条件的ノックインマウスを作成して、病態の解析を行いました。Srsf2変異マウスは、定常状態では造血幹細胞の機能異常を呈するもののMDSを発症しませんでしたが、移植による造血ストレス下でMDSを発症しました。RNAシーケンスによるスプライシング異常の解析を通じて、変異型Srsf2は野生型Srsf2と異なるRNA結合モチーフを認識することで、グローバルなスプライシング異常を誘導すること、MDS発症への関与が知られるコヒーシン遺伝子などの複数の遺伝子がスプライシング異常の標的候補であることを明らかにしました(Kon et al., Blood 2018)。
また、コヒーシン複合体遺伝子の中で最も変異頻度の高いSTAG2変異は、特定の遺伝子変異(RUNX1転写因子の変異など)と共存しやすいことに着目して、複数の遺伝子変異が協調することにより、がんを発症しやすくなるメカニズムをノックアウトマウスを用いて調べました。超解像顕微鏡による細胞内局在の解析、発現解析、ChIPシーケンスによる染色上の分布、Hi-Cによる染色体高次構造の解析などを通じて、コヒーシン複合体は、RUNX1転写因子と共局在して標的遺伝子の発現を制御しており、両者の欠失により染色体三次元構造の破綻と標的遺伝子の発現異常をきたすことを明らかにしました (Ochi, Kon et al. Cancer Discov. 2020)。
私たちは、上記のマウスのみならず、様々な骨髄系腫瘍のドライバー遺伝子変異についてのマウスモデルを構築し、病態解明を進めております。マウスモデルを用いた解析により、遺伝学的背景がコントロールされた条件下で、患者検体では解明が難しい詳細な分子病態に迫ることができます。さらに、ヒト細胞や患者検体を用いた実験を行うことで、ヒトのデータで妥当性を検討し、がんで見られる複雑な遺伝学的な異常に迫りたいと考えています。ゲノム異常にとどまらない、エピジェネティクス異常や、転写後調節の異常などを包括的に理解するために、様々なオミクス解析(RNA-seq, ATAC-seq, ChIP-seq, CUT&Tag, Hi-C解析など)をとりいれて、これらの遺伝子異常によるがんの発症メカニズムを多角的に理解することを目指しています。
3. 先天性造血器腫瘍のゲノム解析・病態解析
生殖細胞系列(胚細胞性)の遺伝子異常により遺伝的にがん易罹患性を呈する疾患はCancer predisposition syndromeと呼ばれますが、近年、成人発症の造血器腫瘍においても、胚細胞性の遺伝子異常を有する病気があることがわかり、がんの早期発見や発がんの分子メカニズムの理解につながる研究が求められています。
従来、先天性の骨髄系腫瘍の原因遺伝子としては、RUNX1, CEBPA, GATA2の胚細胞変異が知られていましたが、これらは全て若年発症で、より頻度が高い成人発症の骨髄系腫瘍の原因遺伝子については知られていませんでした。近年、高齢発症の家族性の骨髄系腫瘍検体の遺伝子解析により、DDX41の機能喪失型の胚細胞変異が5%以上と高頻度に認められ、先天性骨髄系腫瘍の最大のリスク因子であることがわかりました(Polprasert et al., Cancer Cell, 2015)が、その機能については多くが未知の新しいクラスの遺伝子変異です。DDX41変異をもつ細胞が、高齢になりクローン選択を受ける分子メカニズムなどの病態の本質的な疑問に迫り、新しい胚細胞変異に対する治療法開発につなげられる知見を見出すことを目指しています。
4. がんのクローン進化にかかわる分子メカニズムの解明
がん細胞においては、多くの場合、複数の遺伝子変異が共存してみられますが、遺伝子変異はランダムに獲得されるのではなく、ヒエラルキー(階層性)を持って段階的に獲得され、しばしば強い共存・排他関係を有しています。さらに、変異の獲得順序により、最終的には同じ組み合わせの遺伝子変異をもっていても病態が大きく変わることも報告されています。また、がん細胞がクローン選択を受ける過程では、周囲の微小環境(ニッチ)との相互作用も重要な役割を果たすと考えられています。さらに、その反応には、慢性炎症などの外的な因子も影響を与えると考えられており、その分子病態の理解も重要です。こうした疑問を解き明かすために、病態を模倣するマウスモデルを構築したり、患者検体を用いて、たとえば高深度シークエンス技術やシングルセル解析技術などを駆使して、変異の獲得順序や細胞間相互作用がクローン進化メカニズムの過程に及ぼす影響について分子レベルで多角的に理解することを目指しています。





